Mudanças entre as edições de "Teced/textos/grupo36"
| Linha 53: | Linha 53: | ||
| − | <math> E= h{\upsilon} </math> essa energia é emitida quando um átomo de hidrogênio de maior energia, | + | <math> E= h{\upsilon} </math> essa energia é emitida quando um átomo de hidrogênio de maior energia, <math> n_1 </math> passa para um nível menor de energia. |
| − | + | ||
| + | <math> n_2 </math>. | ||
Edição das 14h03min de 30 de outubro de 2014
Conteúdo[ocultar] |
Hidrogênio
O hidrogênio é um elemento químico que pode ser encontrado na tabela periódica. representado pelo símbolo H. Ele apresenta propriedades distintas em relação aos outros elementos químicos, sendo assim não se enquadra em nenhum grupo, mas comumente é colocado na família 1A, pois é o elemento químico mais simples que existe, pois é formado apenas por 1 elétron e 1 próton, sua massa molar é 1,008g/mol. Além disso, ele é o elemento químico que tem menor densidade e apresenta uma massa atômica de aproximadamente 1 u. Em geral ele é encontrado na forma de gás com as seguintes características: inodoro, incolor, inflamável, não-metálico e insolúvel em água.
Este elemento químico é o mais abundante do Universo. É estimado que 75% de toda a massa do Universo seja de átomos de hidrogênio. Em nosso planeta, ele não é tão abundante assim. Ele representa apenas 0,9% da massa do planeta Terra. O hidrogênio ocorre em pequenas proporções na atmosfera (menos que 1ppm em volume). Na forma combinada, ele ocorre principalmente na água, H2O. Na constituição de matéria orgânica, o hidrogênio também está presente. Exemplos são: plantas, animais, petróleo, etc. [1]
Isótopos do Hidrogênio
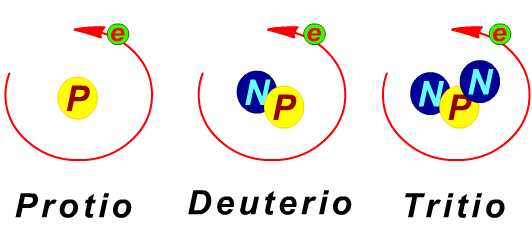
O isótopo do hidrogênio de maior ocorrência é o prótio que é constituído por um único próton e nenhum nêutron. Além deste, pode-se formar dois outros tipos de isótopos, o deutério que possui apenas um nêutron e o trítio com dois nêutrons.
O hidrogênio tem uma importância muito grande para a química ácido-base, já que o hidrogênio forma compostos com a maioria dos outros elementos químicos. Além disso, o hidrogênio proporcionou a resolução analítica da Equação de Schrödinger realizada a partir do estudo energético e de ligações deste elemento, o que foi muito importante para o desenvolvimento da mecânica quântica.
Posição na tabela periódica
O hidrogênio (H) é o primeiro elemento da Tabela Periódica e apresenta características únicas.
A estrutura eletrônica do átomo de hidrogênio se assemelha com a dos metais alcalinos (Grupo 1) , com a dos halogênios e com os elementos do Grupo 14.
No caso da estrutura semelhante com metais alcalinos é devido à tendência muito maior que hidrogênio apresenta de formar ligações covalentes.
Já os halogênios geralmente adquirem elétrons formando íons negativos X-. Não é comum o hidrogênio formar um íon negativo, embora ele forme hidretos iônicos M+H- com alguns metais altamente eletropositivos, justificando sua semelhança com a estrutura eletrônica dos halogênios.
Em alguns aspectos, a estrutura eletrônica do hidrogênio também se parece com as dos elementos do Grupo 14, pois ambos possuem o nível externo semipreenchido.
Pontes de Hidrogênio
Sabe-se que a fonte mais comum de hidrogênio no planeta Terra é a água, cuja substância é formada por moléculas compostas por dois átomos de hidrogênio e um átomo de oxigênio (H-O-H). O átomo de oxigênio atrai mais fortemente os elétrons da ligação do que os átomos de hidrogênio, pois [VOU CONTINUAR]
Níveis de energia do hidrogênio
O físico Niels Henri David Bohr propôs uma mudança no modelo atômico de Rutherford, aplicando a ideia da quantização. Bohr propôs com seu modelo que os elétrons somente ocupariam orbitas bem definidas em torno do núcleo. Considerando um hidrogênio com um próton e um elétron. No modelo de Bohr, o elétron órbita o núcleo em órbitas circulares, com momentum angular.

onde  é a massa do elétron, v sua velocidade, r o raio da órbita, h a constante de Planck e n um número inteiro ( n= 1,2,3, ...).
sendo o momento linear, de acordo de Broglie, é:
é a massa do elétron, v sua velocidade, r o raio da órbita, h a constante de Planck e n um número inteiro ( n= 1,2,3, ...).
sendo o momento linear, de acordo de Broglie, é:

Logo o momento angular será:

por essa equação sabe-se que o tamanho da órbita do elétron deve conter um número inteiro de comprimentos de onda.
Os níveis de energia do hidrogênio são quantizados, já que o número quântico (n) assume números inteiro, isso é, assumindo-se que as órbitas são quantizadas. Para satisfazer a quantização dos estados, um átomo de hidrogênio só pode emitir fótons com energia:
provocando a emissão de um fóton com energia:
 essa energia é emitida quando um átomo de hidrogênio de maior energia,
essa energia é emitida quando um átomo de hidrogênio de maior energia,  passa para um nível menor de energia.
passa para um nível menor de energia.
.
Referências
http://www.quiprocura.net/elementos/hidrogenio.htm
HIDROGÉNIO. In: WIKIPÉDIA, a enciclopédia livre. Flórida: Wikimedia Foundation, 2014. Disponível em: <http://pt.wikipedia.org/w/index.php?title=Hidrog%C3%A9nio&oldid=40245424>. Acesso em: 23 out. 2014.
