Mudanças entre as edições de "Teced/textos/grupo36"
| (18 edições intermediárias de 2 usuários não apresentadas) | |||
| Linha 24: | Linha 24: | ||
Em alguns aspectos, a estrutura eletrônica do hidrogênio também se parece com as dos elementos do Grupo 14, pois ambos possuem o nível externo semipreenchido. | Em alguns aspectos, a estrutura eletrônica do hidrogênio também se parece com as dos elementos do Grupo 14, pois ambos possuem o nível externo semipreenchido. | ||
| − | === Pontes de Hidrogênio === | + | === Pontes de Hidrogênio e Manutenção Vital do Planeta Terra=== |
| − | + | ||
| + | Sabe-se que a fonte mais comum de hidrogênio no planeta Terra é a água, cuja substância é formada por moléculas compostas por dois átomos de hidrogênio e um átomo de oxigênio (H-O-H). O átomo de oxigênio atrai mais fortemente os elétrons da ligação (elétrons partilhados pelo hidrogênio) do que os átomos de hidrogênio, pois o oxigênio possui mais prótons em seu núcleo (8 prótons) do que o átomo hidrogênio. Este tipo de ligação é chamado de '''pontes de hidrogênio'''. | ||
| + | |||
| + | A ligação do tipo pontes de hidrogênio permite a união entre as moléculas de água. Se as pontes de hidrogênio não existissem, a temperatura de ebulição da água poderia chegar a -80°C, o que resultaria na existência da água na superfície terrestre somente na forma gasosa. E então, seria um grande problema para a existência de vida na Terra, pois a água na forma líquida possui propriedades muito importantes, como por exemplo, de ser um solvente universal, porque quando pura, ela possibilita a ionização de inúmeros sais e as ligações do hidrogênio com íons e moléculas em solução, favorecendo a formação de macromoléculas com radicais do tipo OH, CO e COOH <ref>[http://www.lmm.com.br/ibb/html/Noticias_Ciencia_0001.htm]</ref>. E as [http://pt.wikipedia.org/wiki/Macromol%C3%A9cula macromoléculas], por sua vez, são de grande importância, pois são longas cadeias de moléculas ligadas entre si que armazenam informações, como por exemplo, o [http://pt.wikipedia.org/wiki/%C3%81cido_desoxirribonucleico ácido desoxirribonucléico] (DNA). O estado líquido da água, que se encontra entre 0°C e 100°C, é explicado, principalmente, pelas pontes de hidrogênio, que dão uma forte coesão entre as moléculas de <math> H_2O </math>, não permitindo a volatização da água à temperatura existente do nosso planeta. | ||
| + | |||
| + | Olhando para o planeta de maneira termodinâmica, podemos descrevê-lo como um certo tipo de sistema. Esse sistema pode ser delimitado pelo planeta mais a sua atmosfera (o motivo da participar desse sistema será descrito mais adiante). Este sistema pode ser classificado em aberto ou fechado e para isso, deveremos levar em conta algumas considerações. A primeira delas diz respeito ao equilíbrio a sistemas fechados, pois um sistema pode estar em equilíbrio térmico, equilíbrio termodinâmico, ou então os dois ao mesmo tempo. Porém, se olharmos para a Terra, podemos ver que é difícil encontrar elementos que estejam em equilíbrio termodinâmico, por exemplo. Então, ao observamos a natureza nos deparamos com sistemas de não equilíbrio termodinâmico, sendo que em alguns desses casos possam ocorrer sistemas que possuam algum tipo de equilíbrio local. Para isso, podemos definir um tipo de estado que pode ser denominado equilíbrio dinâmico, no qual alguma constante nesse sistema se mantém renovada no decorrer do tempo, e sendo assim, este tipo de equilíbrio é típico de um sistema aberto. Em outras palavras, podemos exemplificar esse caso de equilíbrio dinâmico como o fluxo constante de entrada e saída de energia em que o nosso Planeta Terra possui (sistema aberto). | ||
| + | |||
| + | Em termos de fluxo de energia, sistema aberto e diminuição da entropia local, podemos descrever um planeta como o nosso de maneira que possua essas características, pois nele há um fluxo permanente de energia proveniente do Sol que mantém a manutenção dos seres vivos. Parte dessa energia é armazenada, ou então, utilizada nos processos vitais como a fotossíntese, que contribui para a organização local e manutenção da vida. Talvez isso seja uma razão na qual a vida como a conhecemos esteja em um planeta que orbita em torno de uma estrela. | ||
| + | |||
| + | A partir dos tratamentos dados ao fluxo de energia no sistema aberto, deve ser interessante dizer a respeito de como se dá esse fluxo no sistema.Para que haja manutenção dos seres vivos por meio da energia, há uma necessidade pelo meio no qual essa energia seja transportada entre os seres. Para isso, é preciso que esse meio necessite de interligar e garantir a circulação da energia nesse sistema, e intuitivamente poderemos pensar num meio que seja abundante no sistema. | ||
| + | |||
| + | Portanto, entre essas razões, a água se torna como forte candidata a ser o meio de circulação do fluxo de energia. E por isso, as pontes de hidrogênio são importantes para a existência da água. A água está presente em grande porcentagem na maioria dos seres vivos e ela é de grande importância, pois a água possui uma temperatura de fusão 0°C e de ebulição 100°C (a pressão de uma atmosfera), sendo superior às temperaturas de fusão e ebulição de outros compostos que são parecidos com ela. Além disso, a água é um composto bastante estável e super importante para a reação da maioria dos outros elementos, como os [http://pt.wikipedia.org/wiki/Metal_alcalino metais alcalinos] para a formação de [http://pt.wikipedia.org/wiki/Base_%28qu%C3%ADmica%29 bases], com alguns [http://pt.wikipedia.org/wiki/%C3%93xido óxidos] metálicos, para formar [http://pt.wikipedia.org/wiki/Hidr%C3%B3xido hidróxidos], e não metálicos, formando [http://pt.wikipedia.org/wiki/Hidr%C3%B3xido ácidos], sendo todos estes produtos de grande importância para os processos vitais no nosso sistema aberto. | ||
===Níveis de energia do hidrogênio=== | ===Níveis de energia do hidrogênio=== | ||
| Linha 45: | Linha 55: | ||
por essa equação sabe-se que o tamanho da órbita do elétron deve conter um número inteiro de comprimentos de onda. | por essa equação sabe-se que o tamanho da órbita do elétron deve conter um número inteiro de comprimentos de onda. | ||
| − | + | ||
| − | + | Os níveis de energia do hidrogênio são quantizados, já que o número quântico (n) | |
| − | + | assume números inteiro, isso é, assumi-se que as órbitas são quantizadas. | |
Para satisfazer a quantização dos estados, um átomo de hidrogênio só pode emitir fótons com energia: | Para satisfazer a quantização dos estados, um átomo de hidrogênio só pode emitir fótons com energia: | ||
| − | + | <math> h{\upsilon}= E(n_1) - E(n_2) </math> provocando a emissão de um fóton com energia: <math> E= h{\upsilon} </math> | |
| − | + | essa energia é emitida quando um átomo de hidrogênio de maior energia, <math> n_1 </math> passa para um nível menor de energia | |
| − | <math> | + | <math> n_2 </math>. |
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
===Referências=== | ===Referências=== | ||
| Linha 62: | Linha 68: | ||
<references/> http://www.quiprocura.net/elementos/hidrogenio.htm | <references/> http://www.quiprocura.net/elementos/hidrogenio.htm | ||
| + | Oliveira Filho, Kepler de Souza/ Astronomia e astrofísica, 2013 | ||
HIDROGÉNIO. In: WIKIPÉDIA, a enciclopédia livre. Flórida: Wikimedia Foundation, 2014. Disponível em: <http://pt.wikipedia.org/w/index.php?title=Hidrog%C3%A9nio&oldid=40245424>. Acesso em: 23 out. 2014. | HIDROGÉNIO. In: WIKIPÉDIA, a enciclopédia livre. Flórida: Wikimedia Foundation, 2014. Disponível em: <http://pt.wikipedia.org/w/index.php?title=Hidrog%C3%A9nio&oldid=40245424>. Acesso em: 23 out. 2014. | ||
| + | |||
| + | Pacheco, J. A. de Freitas - O DESAFIO DA ASTRONOMIA NO SÉCULO XXI: ESTAMOS SOZINHOS NO UNIVERSO? <http://www.lmm.com.br/ibb/html/Noticias_Ciencia_0001.htm> Acesso em: 30 de outubro de 2014. | ||
Edição atual tal como às 17h57min de 30 de outubro de 2014
Conteúdo[ocultar] |
[editar] Hidrogênio
O hidrogênio é um elemento químico que pode ser encontrado na tabela periódica. representado pelo símbolo H. Ele apresenta propriedades distintas em relação aos outros elementos químicos, sendo assim não se enquadra em nenhum grupo, mas comumente é colocado na família 1A, pois é o elemento químico mais simples que existe, pois é formado apenas por 1 elétron e 1 próton, sua massa molar é 1,008g/mol. Além disso, ele é o elemento químico que tem menor densidade e apresenta uma massa atômica de aproximadamente 1 u. Em geral ele é encontrado na forma de gás com as seguintes características: inodoro, incolor, inflamável, não-metálico e insolúvel em água.
Este elemento químico é o mais abundante do Universo. É estimado que 75% de toda a massa do Universo seja de átomos de hidrogênio. Em nosso planeta, ele não é tão abundante assim. Ele representa apenas 0,9% da massa do planeta Terra. O hidrogênio ocorre em pequenas proporções na atmosfera (menos que 1ppm em volume). Na forma combinada, ele ocorre principalmente na água, H2O. Na constituição de matéria orgânica, o hidrogênio também está presente. Exemplos são: plantas, animais, petróleo, etc. [1]
[editar] Isótopos do Hidrogênio
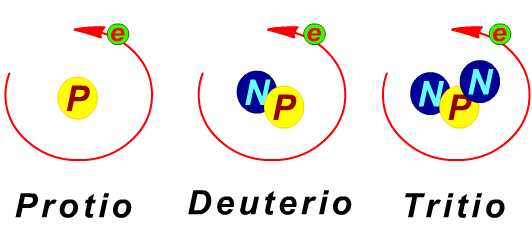
O isótopo do hidrogênio de maior ocorrência é o prótio que é constituído por um único próton e nenhum nêutron. Além deste, pode-se formar dois outros tipos de isótopos, o deutério que possui apenas um nêutron e o trítio com dois nêutrons.
O hidrogênio tem uma importância muito grande para a química ácido-base, já que o hidrogênio forma compostos com a maioria dos outros elementos químicos. Além disso, o hidrogênio proporcionou a resolução analítica da Equação de Schrödinger realizada a partir do estudo energético e de ligações deste elemento, o que foi muito importante para o desenvolvimento da mecânica quântica.
[editar] Posição na tabela periódica
O hidrogênio (H) é o primeiro elemento da Tabela Periódica e apresenta características únicas.
A estrutura eletrônica do átomo de hidrogênio se assemelha com a dos metais alcalinos (Grupo 1) , com a dos halogênios e com os elementos do Grupo 14.
No caso da estrutura semelhante com metais alcalinos é devido à tendência muito maior que hidrogênio apresenta de formar ligações covalentes.
Já os halogênios geralmente adquirem elétrons formando íons negativos X-. Não é comum o hidrogênio formar um íon negativo, embora ele forme hidretos iônicos M+H- com alguns metais altamente eletropositivos, justificando sua semelhança com a estrutura eletrônica dos halogênios.
Em alguns aspectos, a estrutura eletrônica do hidrogênio também se parece com as dos elementos do Grupo 14, pois ambos possuem o nível externo semipreenchido.
[editar] Pontes de Hidrogênio e Manutenção Vital do Planeta Terra
Sabe-se que a fonte mais comum de hidrogênio no planeta Terra é a água, cuja substância é formada por moléculas compostas por dois átomos de hidrogênio e um átomo de oxigênio (H-O-H). O átomo de oxigênio atrai mais fortemente os elétrons da ligação (elétrons partilhados pelo hidrogênio) do que os átomos de hidrogênio, pois o oxigênio possui mais prótons em seu núcleo (8 prótons) do que o átomo hidrogênio. Este tipo de ligação é chamado de pontes de hidrogênio.
A ligação do tipo pontes de hidrogênio permite a união entre as moléculas de água. Se as pontes de hidrogênio não existissem, a temperatura de ebulição da água poderia chegar a -80°C, o que resultaria na existência da água na superfície terrestre somente na forma gasosa. E então, seria um grande problema para a existência de vida na Terra, pois a água na forma líquida possui propriedades muito importantes, como por exemplo, de ser um solvente universal, porque quando pura, ela possibilita a ionização de inúmeros sais e as ligações do hidrogênio com íons e moléculas em solução, favorecendo a formação de macromoléculas com radicais do tipo OH, CO e COOH [2]. E as macromoléculas, por sua vez, são de grande importância, pois são longas cadeias de moléculas ligadas entre si que armazenam informações, como por exemplo, o ácido desoxirribonucléico (DNA). O estado líquido da água, que se encontra entre 0°C e 100°C, é explicado, principalmente, pelas pontes de hidrogênio, que dão uma forte coesão entre as moléculas de  , não permitindo a volatização da água à temperatura existente do nosso planeta.
, não permitindo a volatização da água à temperatura existente do nosso planeta.
Olhando para o planeta de maneira termodinâmica, podemos descrevê-lo como um certo tipo de sistema. Esse sistema pode ser delimitado pelo planeta mais a sua atmosfera (o motivo da participar desse sistema será descrito mais adiante). Este sistema pode ser classificado em aberto ou fechado e para isso, deveremos levar em conta algumas considerações. A primeira delas diz respeito ao equilíbrio a sistemas fechados, pois um sistema pode estar em equilíbrio térmico, equilíbrio termodinâmico, ou então os dois ao mesmo tempo. Porém, se olharmos para a Terra, podemos ver que é difícil encontrar elementos que estejam em equilíbrio termodinâmico, por exemplo. Então, ao observamos a natureza nos deparamos com sistemas de não equilíbrio termodinâmico, sendo que em alguns desses casos possam ocorrer sistemas que possuam algum tipo de equilíbrio local. Para isso, podemos definir um tipo de estado que pode ser denominado equilíbrio dinâmico, no qual alguma constante nesse sistema se mantém renovada no decorrer do tempo, e sendo assim, este tipo de equilíbrio é típico de um sistema aberto. Em outras palavras, podemos exemplificar esse caso de equilíbrio dinâmico como o fluxo constante de entrada e saída de energia em que o nosso Planeta Terra possui (sistema aberto).
Em termos de fluxo de energia, sistema aberto e diminuição da entropia local, podemos descrever um planeta como o nosso de maneira que possua essas características, pois nele há um fluxo permanente de energia proveniente do Sol que mantém a manutenção dos seres vivos. Parte dessa energia é armazenada, ou então, utilizada nos processos vitais como a fotossíntese, que contribui para a organização local e manutenção da vida. Talvez isso seja uma razão na qual a vida como a conhecemos esteja em um planeta que orbita em torno de uma estrela.
A partir dos tratamentos dados ao fluxo de energia no sistema aberto, deve ser interessante dizer a respeito de como se dá esse fluxo no sistema.Para que haja manutenção dos seres vivos por meio da energia, há uma necessidade pelo meio no qual essa energia seja transportada entre os seres. Para isso, é preciso que esse meio necessite de interligar e garantir a circulação da energia nesse sistema, e intuitivamente poderemos pensar num meio que seja abundante no sistema.
Portanto, entre essas razões, a água se torna como forte candidata a ser o meio de circulação do fluxo de energia. E por isso, as pontes de hidrogênio são importantes para a existência da água. A água está presente em grande porcentagem na maioria dos seres vivos e ela é de grande importância, pois a água possui uma temperatura de fusão 0°C e de ebulição 100°C (a pressão de uma atmosfera), sendo superior às temperaturas de fusão e ebulição de outros compostos que são parecidos com ela. Além disso, a água é um composto bastante estável e super importante para a reação da maioria dos outros elementos, como os metais alcalinos para a formação de bases, com alguns óxidos metálicos, para formar hidróxidos, e não metálicos, formando ácidos, sendo todos estes produtos de grande importância para os processos vitais no nosso sistema aberto.
[editar] Níveis de energia do hidrogênio
O físico Niels Henri David Bohr propôs uma mudança no modelo atômico de Rutherford, aplicando a ideia da quantização. Bohr propôs com seu modelo que os elétrons somente ocupariam orbitas bem definidas em torno do núcleo. Considerando um hidrogênio com um próton e um elétron. No modelo de Bohr, o elétron órbita o núcleo em órbitas circulares, com momentum angular.

onde  é a massa do elétron, v sua velocidade, r o raio da órbita, h a constante de Planck e n um número inteiro ( n= 1,2,3, ...).
sendo o momento linear, de acordo de Broglie, é:
é a massa do elétron, v sua velocidade, r o raio da órbita, h a constante de Planck e n um número inteiro ( n= 1,2,3, ...).
sendo o momento linear, de acordo de Broglie, é:

Logo o momento angular será:

por essa equação sabe-se que o tamanho da órbita do elétron deve conter um número inteiro de comprimentos de onda.
Os níveis de energia do hidrogênio são quantizados, já que o número quântico (n) assume números inteiro, isso é, assumi-se que as órbitas são quantizadas. Para satisfazer a quantização dos estados, um átomo de hidrogênio só pode emitir fótons com energia:
 provocando a emissão de um fóton com energia:
provocando a emissão de um fóton com energia:  essa energia é emitida quando um átomo de hidrogênio de maior energia,
essa energia é emitida quando um átomo de hidrogênio de maior energia,  passa para um nível menor de energia
passa para um nível menor de energia
 .
.
[editar] Referências
http://www.quiprocura.net/elementos/hidrogenio.htmOliveira Filho, Kepler de Souza/ Astronomia e astrofísica, 2013
HIDROGÉNIO. In: WIKIPÉDIA, a enciclopédia livre. Flórida: Wikimedia Foundation, 2014. Disponível em: <http://pt.wikipedia.org/w/index.php?title=Hidrog%C3%A9nio&oldid=40245424>. Acesso em: 23 out. 2014.
Pacheco, J. A. de Freitas - O DESAFIO DA ASTRONOMIA NO SÉCULO XXI: ESTAMOS SOZINHOS NO UNIVERSO? <http://www.lmm.com.br/ibb/html/Noticias_Ciencia_0001.htm> Acesso em: 30 de outubro de 2014.
